מחקר
פריצות דרך במחקר
ב- 2007 פורסם מחקרו של פרופ' אדריאן בירד, שמומן בשיתוף העמותה לתסמונת רט, תחת ההכרזה הדרמטית כי תסמונת רט הינה הפיכה! (כלומר ניתנת לריפוי). פרופ' בירד, הצליח במודל עכברים "להפוך" את הגן הגורם לתסמונת רט ולרפא עכברים בוגרים הסובלים מהתסמונת אך הדרך להגיע להישג זה על בני אדם לא הייתה ידועה.
שש שנים לאחר מכן ב- 2013, במחקר נוסף שהעמותה לתסמונת רט היתה שותפה במימונו, פרופ' גייל מנדל נתנה לנו את התשובה – ריפוי גנטי שניתן ליישום על בני אדם ולא רק על מודלים של בעלי חיים.
להלן סרטון "לפני" וסרטון "אחרי" של הניסוי במעבדתו של פרופ' בירד וסרטון ממעבדתה של פרופ' מנדל של עכבר שטופל בתרפיה גנטית ועכבר שלא טופל, הממחישים את "חזרת הגלגל לאחור" וחזרתם של תאי המוח הפגועים לתפקוד תקין מלא.
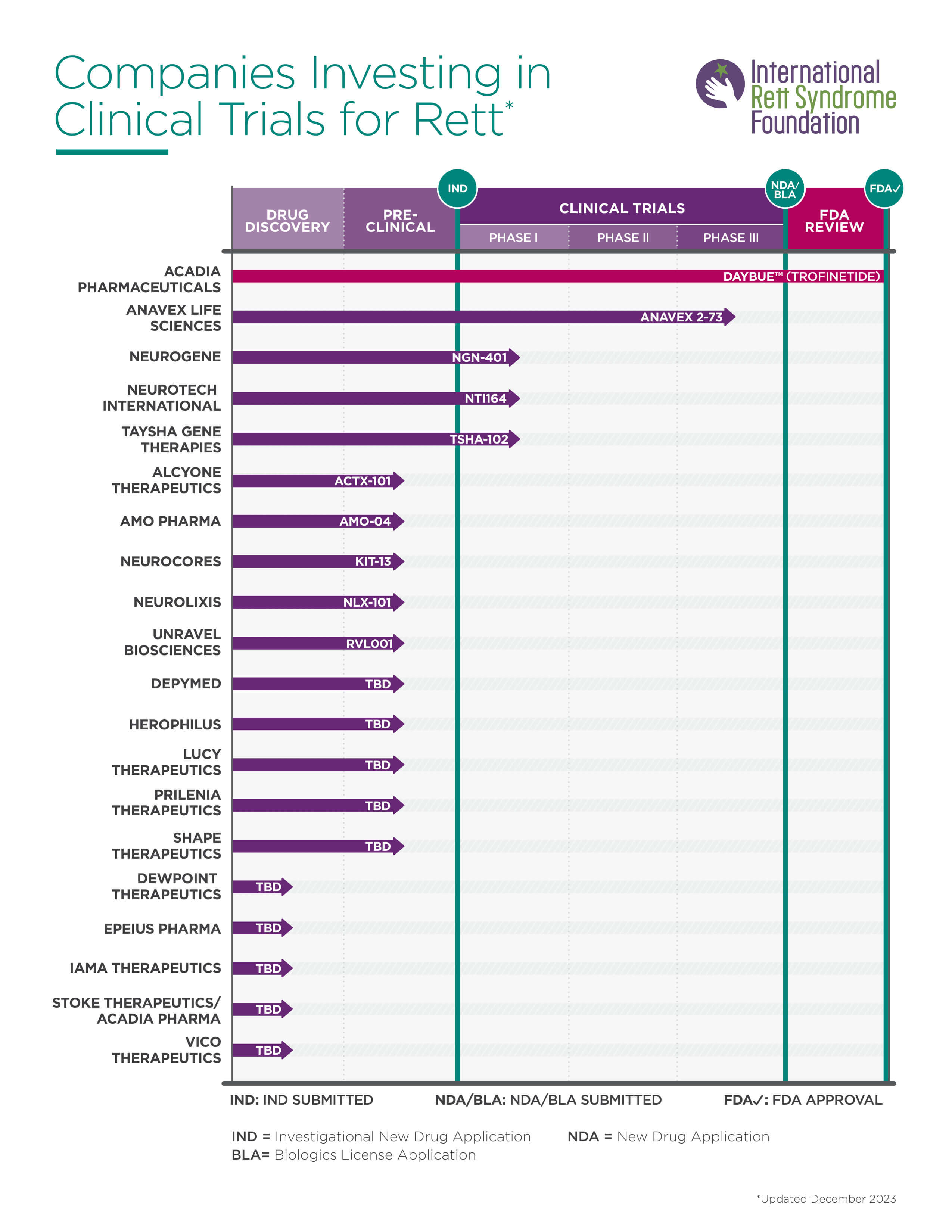
מחקרים קליניים
עדכונים שוטפים:
8/5/2024
חברת התרופות Neurogene דיווחה על נתוני בטיחות וסבילות ראשוניים מהניסוי הקליני של ריפוי גנטי שלב 1/2 לתסמונת רט, שהראה כי הטיפול הגנטי NGN-401 נסבל באופן כללי היטב על ידי כל שלושת החולות הראשונות, ללא סימנים של רעילות או ביטוי יתר של הגן, עם מעקב של כתשעה, שישה ושלושה חודשים לאחר קבלת הטיפול. ניסוי שלב 1/2 מעריך את הבטיחות, הסבילות והיעילות הראשונית של שתי רמות מינון (נמוך וגבוה) של NGN-401 באמצעות עירוי חד-פעמי תוך-מוחי (ICV) של חולות בגילאי 4-10 שנים עם תסמונת רט קלאסית . בעקבות כך, המחקר הורחב מ- 5 חולות ל- 16. מחצית מהבנות יקבלו מינון נמוך ומחצית מינון גבוה של הטיפול. חולות תגוייסנה מארה"ב ואנגליה.
7/5/2024
חברת Neurotech International דיווחה על תוצאות חיוביות מהניסוי הקליני המתמשך שלהם שלב I/I באוסטרליה של NTI164 טיפול תרופתי קנבינואידי רחב היקף לטיפול בתסמונת רט. לאחר 12 שבועות ללא תופעות לוואי, החברה דיווחה כי 93% מהמשתתפים הראו שיפור בהתבסס על סולם CGI-I וכי השיפור הממוצע משבוע 4 עד 12 ב- RSBQ היה 205% בתסמינים כולל תקשורת, התנהגויות ידיים, חרדה/מצב רוח ואיכות חיים.
22/4/2024
חברת Acadia Pharmaceuticals הודיעה כי הגשת התרופה טרופינטיד התקבלה והוענקה לה סקירת עדיפות על ידי משרד הבריאות בקנדה לטיפול בתסמונת רט. התרופה כבר מאושרת וזמינה באופן מסחרי בארה"ב תחת השם DAYBUE™ לבנות בוגרות וצעירות מגיל שנתיים. זוהי התרופה הראשונה אי פעם שאושרה לתסמונת רט. לחברה זכויות לשיווק התרופה בצפון אמריקה, כמו גם זכויות עולמיות.
2/4/2024
חברת DepYmed קיבלה לאחרונה אישור מה- FDA האמריקאי להתחיל ניסוי קליני שלב 1 עם התרופה שלהם DPM-1003 לטיפול בתסמונת רט. הטיפול פועל על ידי עיכוב PTP1B הראה תוצאות טובות במודלים קדם-קליניים של תסמונת רט.
19/3/2024
חברת Taysha Therapies שיתפה נתוני ביניים משני החולות המבוגרות הראשונות שקיבלו את הטיפול TSHA-102. לא דווח על תופעות לוואי חמורות. שתי החולות הראו שיפורים מתמשכים וחדשים, לרבות בתפקוד אוטונומי (דפוסי שינה ונשימה), סוציאליזציה/תקשורת (עניין חברתי, ווקליזציה ושימוש במכשיר תקשורת מונע עיניים), מיומנויות מוטוריות (תפקוד יד, ישיבה ללא עזרה וסטריאוטיפים ביד), והתקפים (יציבות וחוסר תחושה). בנוסף החברה קיבלה אישור להתקדם מיד לקוהורטה 2 (מינון גבוה). החולה הראשונה בקבוצת המינון הגבוה תקבל את הטיפול ברבעון השני ב- 2024. המחקר בבנות המבוגרות יותר מתקיים בקנדה והוגשה בקשה ל- FDA להרחיבו גם לארה"ב. בנוסף, בקרוב ילדה נוספת בקבוצת הגילאים 5-8 שנים תקבל את הטיפול הגנטי (מינון נמוך) וילדה ראשונה תקבל את הטיפול הגנטי במינון הגבוה במחצית השניה ב- 2024. לאחר מכן הניסוי יורחב לגילאי 3-5. הניסוי בבנות הצעירות מתקיים בארה"ב.
28/6/2023
חברת Anavex Life Sciences שיתפה בחדשות מרגשות על התרופה שלהם בשם ANAVEX®2-73 (הידועה גם בשם בלרקמזין) לבנות בוגרות עם תסמונת רט. תרופה זו נלקחת דרך הפה ופועלת על ידי הפעלת קולטן ספציפי בגוף, שעוזר להחזיר את האיזון ולקדם את הסתגלות המוח. במחקר שלהם, כמעט כל 25 החולות שהשלימו את החלק הראשוני של המחקר בחרו להמשיך לשלב הבא של 12 השבועות. התוצאות מבטיחות. היתרונות שנראו בחלק הראשון של המחקר נמשכו לשלב הבא של 12 השבועות. הנתונים מצביעים על כך ש-ANAVEX®2-73 (בלרקמזין) לא רק עוזרת להפחית את הסימפטומים של תסמונת רט, אלא גם מאטה את התקדמות המחלה ובכך עשויה לשנות את מהלך המחלה. למעשה, חולות שהחלו ליטול ANAVEX®2-73 מוקדם יותר במחקר והמשיכו ליטול אותו בשלב הבא הראו ירידה משמעותית בחומרת המחלה בהשוואה לאלה שהחלו ליטול אותה בשלב מאוחר יותר.
18/6/2024
חברת Taysha Gene Therapies חשפה נתונים קליניים חיוביים מהניסוי על מטופלות מבוגרות וילדות מקבוצת מינון נמוך REVEAL שלב 1/2 של הטיפול TSHA-102 בתסמונת רט. החברה דיווחה על שיפורים עמידים בתחומים קליניים עקביים במטופלות מבוגרות וצעירות, כולל מיומנויות מוטוריות, תקשורת/סוציאליזציה, תפקוד אוטונומי-נשימה, התקפים אפילפטיים וכן על פרופיל בטיחות מעודד שנראה בקרב מטופלות מבוגרות וילדות, עם חומרת מוטציה גנטית שונה. כך לדוגמא, מטופלת בת 20 ישבה ללא סיוע בפעם הראשונה מזה למעלה מעשור ולמטופלת השנייה בת 21 השתפרו תנועות סטריאוטיפיות של הידיים ושהחלו בגיל שלוש ולא היו לה פרכוסים למשך 8.5 חודשים. המטופלת בת ה- 6 הצליחה להחזיק חפץ במשך שלוש דקות ולשבת ללא סיוע למשך זמן ארוך יותר. המטופלת בת ה- 7 הצליחה לקום מכיסא ולעלות מדרגות.
לצפייה בטבלת מחקרים – לחצו כאן
Roadmap to a Cure 2.0 – תכנית מפת הדרכים לריפוי 2024
מַהְפֵּכָת הרפואה הגנטית כאן!
בחודש מאי 2024 השיקה עמותת האחות שלנו בארה"ב תכנית המבוססת על עשרות שנים של התקדמות מדעית בעלות של 40 מיליון דולר. מפת הדרכים לריפוי תבחר ותניע חדשנות עבור שלוש תרופות גנטיות שתוקפות את שורש הבעיה של תסמונת רט, ותתקדם לניסויים קליניים עד 2028.
רקע:
תרופות גנטיות מורכבות משני חלקים: המטען ((the cargo המתקן את המוטציה וטכנולוגיית שליחה/מסירה (delivery technology) שמכניסה את המטען לתאים.
המטען – קיימות שש גישות מחקריות:
טיפול גנטי: הכנסת גנים בריאים לגוף כדי לפצות על גנים שעברו מוטציה. גישה זו היא המתקדמת ביותר מבין הטיפולים הגנטיים וכבר נמצאת בניסויים קליניים על ילדות ונשים עם תסמונת רט. גישה זו רלוונטית לכל סוגי מוטציות MECP2.
עריכה בסיסית: גישה זו מאפשרת שינויים מדויקים ברצף ה-DNA במקומות ספציפיים וניתן להשתמש בהם כדי לתקן מוטציות נקודתיות (שגיאות הקלדה בבסיס נוקלאוטיד בודד).
עריכה ראשונית: גישה זו משתרעת מעבר לעריכה בסיסית ומתייחסת למגוון רחב של מוטציות כולל הכפלות וחסרים. גישה זו יכולה לתקן מוטציות מרובות הממוקמות זו ליד זו על הגן. עם הזמן, עריכת פריים תטפל בכל המוטציות של MECP2.
הפעלה מחדש של הגן: לכל נקבה יש שני כרומוזומי X, אחד פעיל ואחד לא פעיל. בתאים שבהם הגן שעבר מוטציה פעיל, קיים גן גיבוי בריא על כרומוזום X הלא פעיל. המטרה של גישה זו היא לעורר את הגן הבריא והמושתק. גישה זו רלוונטית לכל סוגי המוטציות MECP2.
עריכת RNA: גישה זו ממירה נוקלאוטיד אחד לאחר בתוך רצף ה-RNA וניתן להשתמש בה למוטציות נקודתיות ספציפיות.
חיבור RNA: הגן MECP2 מורכב מ-4 אקסונים. גישה זו מחליפה אקסונים שעברו מוטציה באקסונים בריאים. גישה זו רלוונטית לכל מוטציות MECP2.
מסירה/שליחה – קיימות שלוש טכניקות:
באמצעות וירוסים: וירוסים יעילים מאוד בהעברת החומר הגנטי שלהם לתאים במהלך ההדבקה. ניתן לרתום פונקציה זו כדי לאפשר לוירוסים לשמש כלי מסירה למטענים גנטיים.
באמצעים לא ויראליים: אמצעי מסירה משתרעים מעבר לנגיפים וכוללים גישות כגון ננו-חלקיקים, שומנים ואקסוזומים. משלוח לא ויראלי מציע מספר יתרונות חשובים.
באמצעות RNA קטן: RNA קטן מסוגל להעביר את עצמו ולא צריך משלוח ויראלי או לא ויראלי. הם נמצאים בשימוש קליני במשך שנים רבות בהצלחה רבה.
הניצוץ הראשון בפיתוח תרופה חדשה מתרחש בדרך כלל עם גילוי במעבדה אקדמית. בדיקה בתרביות תאים מלווה בניסויים במודלים של בעלי חיים. כשיש נתונים מעודדים ביד, הקניין הרוחני (IP) מתויק. מדענים מקימים לפעמים חברה המעניקה רישיונות ל-IP מהמוסד האקדמי. עם זאת, לעתים קרובות יותר, המוסד משווק את ה-IP לחברות ביו-פארמה. לאחר רישיון ה-IP, חברת הביופרמה מתחילה לעבוד על אינדיקציה למחלה.
הפער בין האקדמיה לביופארמה מכונה לעתים קרובות "עמק המוות", מכיוון שרוב התגליות לעולם אינן צולחות את המעבר. תפקידנו לבטל את "עמק המוות" על ידי גישור הפער ביניהם.
התכנית מעניקה מימון אסטרטגי למדענים אקדמיים מובחרים כדי להבטיח צינור חזק של מטענים ואמצעי משלוח. כאשר תהליכי העבודה הללו קורים, אנו משלבים את השילובים הטובים ביותר של משתפי פעולה, ובו זמנית מסדרים שותפי ביו-פארמה כדי לקדם את התוכניות לתוך הקליניקה.
פיתוח תרופות גנטיות הוא עסק מסוכן הן בצד המדעי והן בצד העסקי. פיתוח תרופות גנטיות עבור תסמונת רט לא קורה מעצמו. זה מאמץ שיש להניע, לתיווך ולפקח עליו מקרוב. זה דורש ניסיון מעמיק בתעשייה ובפיתוח עסקי ועקשנות!
למידע נוסף לחצו כאן.
תכנית 'Cure 360' – תוקפים את תסמונת רט מכל זווית!! מוצאים תרופה לתסמונת רט! 2020
לפני שלוש שנים השיקה עמותת האחות שלנו בארה"ב את תכנית 'Roadmap to Cure' שמטרתה הייתה מימון מחקרים שיחקרו את שורש הבעיה של תסמונת רט – מוטציות בגן ,MECP2 על מנת למצוא ריפוי מלא לתסמונת. במהלך שלושת השנים הללו העמותה לתסמונת בישראל היתה שותפה מלאה למימון 15 מחקרים בשש אסטרטגיות מחקר שונות כדי למצוא ריפוי לתסמונת רט, המתקדמת ביניהן היא ריפוי גנטי. בתחילת התכנית היו אפס חברות ביופארמה שעבדו על פיתוח תרופה לתסמונת רט ואילו היום יש שש חברות.
הצטרפו אלינו לשלב הבא בריפוי תסמונת רט 'Cure 360'
בעזרתכם, ובעזרת השותפים שלנו, אנחנו נהיה חממה מחקרית של מחקרים שיבשילו עבור חברות ביופארמה שיקדמו וישיקו תכניות ריפוי מוחלט לתסמונת רט המתבססות על המחקרים האקדמיים בכל ששת אסטרטגיות המחקר. להמשך קריאה לחצו פה.
תכנית 'מפת הדרכים לריפוי' 2017
תסמונת רט היא הפרעה נוירולוגית חמורה שפוגעת בכ – 350 אלף בנות ונשים בעולם. ילדות עם תסמונת רט מתפתחות לכאורה בצורה תקינה עד גיל חצי שנה-שנה וחצי ואז נסוגות ומאבדות את היכולת ללכת ולדבר. מרבית הילדות מפתחות התקפים אפילפטיים, נשימה לא סדירה, עקמת, בעיות במערכת העיכול. זוהי מחלה אכזרית שכולאת את הילדות בתוך בגופן.
קשה לדמיין את הסימפטומים של אוטיזם, מחלת פרקינסון, שיתוק מוחין, אפילפסיה והפרעת חרדה – הכל בתוך גוף של ילדה אחת. זו תסמונת רט עבור אלפי ילדות ונשים.
העמותה לתסמונת רט פועלת ימים כלילות לממן מחקרים למציאת תרופה לתסמונת רט ולשחרר את הבנות מהכלא בו הן נמצאות.
המטרה שלנו היא שאפתנית ובעלת פוטנציאל היסטורי: להפוך את תסמונת רט להפרעה הנוירולוגית הראשונה בת ריפוי ויש לנו את כל הסיבות להיות בטוחים שזה אפשרי. 1) הגורם ידוע, מוטציה אקראית על גן אחד. 2) הצליחו במודלים של עכברי מעבדה לרפא את התסמונת. 3) מחקר בתסמונת רט עשוי לפתוח דלתות לפיתוח טיפולים וריפוי במחלות אחרות כגון סכיזופרניה, הפרעה דו קוטבית ואוטיזם, דבר שישפיע על חייהם של מיליוני אנשים נוספים.
בחודש מרץ 2017 הכריזה הקרן האמריקאית לתסמונת רט על תוכנית תלת שנתית לריפוי התסמונת. אנו לא נסתפק בהקלה ושיפור סימפטומי. אנו רוצים ריפוי. התוכנית מורכבת ממספר תחומים ותקציבה 33,000,000 מיליון דולר.
ריפוי – עלות המימון 13 מיליון דולר בליבת התוכנית ארבע גישות שנועדו לרפא תסמונת רט על ידי תיקון הסיבה הבסיסית של התסמונת. ארבע גישות אלה מייצגות את חוד החנית של מדע הרפואה.
תרפיה גנטית: לפני שלוש שנים מוקם קונסורציום המורכב ממומחים מארבע מעבדות מובילות בתחום של תרפיה גנטית שדוחף את המחקר ומראה שבכל הנוגע לתסמונת רט, תרפיה גנטית היא התערבות יעילה ובטוחה בדרך לריפוי, הרבה יותר מכל ההתערבויות אחרות באמצעות תרופות (כל זאת במודל עכברי מעבדה). מטרתנו להגיע במהרה לקבלת אישור של ה- FDA ולבצע ניסוי קליני שלב I.
רה-אקטיבציה של הגן MECP2: אצל בנות ונשים עם תסמונת רט, כרומוזום X הפעיל מכיל את הגן הפגום הגורם לתסמונת. אבל כרומוזום X רדום מכיל עותק בריא של אותו הגן. אם מדענים יצליחו לגלות תרופה ש"מעירה" את הגן הרדום אך הבריא של MECP2, זה עשוי לרפא תסמונת רט. תחום זה מובל על ידי קונסורציום של שבע מעבדות מובילות אשר בשלוש השנים הקרובות ימצא תרופות שיובילו לבדיקות פרה-קליניות ומכאן למחקרים קליניים. עריכה של RNA: תסמונת רט נגרמת על ידי מוטציות בגן MECP2. המוטציה הגנטית משועתקת ל- RNA שאינו תקין המתורגם לאחר מכן לחלבון שאינו מתפקד. בנוסף להתמקדות ברמת הדנ"א באמצעות תרפיה גנטית או תיקון רמת החלבון, מטרת גישה חלופית זו במהלך שלוש השנים הבאות, לשפר את היעילות של עריכת RNA בנוירונים בעזרת טכנולוגייתSMaRT והחדרת ה- RNA התקין. החלפת חלבונים: שורש הבעיה בתסמונת רט הוא רמת החלבון הספציפי במוח. בעזרת שיתוף פעולה עם חברת ביוטכנולוגיה מובילה שפיתחה דרך המאפשרת העברה פעילה של חלבונים למוח, מטרתנו לבחון גישה זו במודלים של בעלי חיים.
טיפול – עלות המימון 3.3 מיליון דולר הגישות המרפאות לעיל המתמודדות עם הסיבה הבסיסית של ההפרעה צפויות לספק תועלת טיפולית עמוקה. עם זאת, התערבויות טיפוליות במורד הזרם עשויות לשפר סימפטום או תת קבוצה של סימפטומים. עד להשגת תרופה מוחלטת מלאה, נעריך במקביל את אסטרטגיות הטיפול עם הפוטנציאל הגדול ביותר לשיפור הסימפטומים הקשים של התסמונת.
אפשור – עלות המימון – 9.2 מיליון דולר מטרתנו להסיר את המחסומים ובכך לקצר את הזמן לפיתוח תרופות, והקלה על אישור טיפולים חדשניים. בעשותנו כך נוכל להניע השקעות בתעשייה במחקר בתסמונת רט. מבחינה היסטורית, האישור של תרופות חדשות נעצר על ידי היעדרם של מספר משאבים מרכזיים: 1) היעדר מדדים מדויקים שאושרו על – ידי ה – FDA לניסויים קליניים, כולל מכשירים שיכולים למדוד במדויק את התוצאות הללו, 2) היכולת לזהות את המטופלים הנכונים עבור הניסויים הנכונים, ו- 3) היעדר תאי אדם מחולים לבדיקת טיפולים חדשים במעבדה. מדדי תוצאה ופיתוח ביומרקרים: אין כיום מדדי תוצאות שאושרו על ידי ה- FDA לשימוש בניסויים קליניים של תסמונת רט ולכן הוקם קונסורציום של רופאים מומחים בתחום תסמונת רט כדי לפתח אמצעי מדידה משמעותיים לחולים ובני משפחותיהם ואשר מקובלים על ה- FDA ועל רשויות רגולטוריות בינלאומיות אחרות. בדיקת ההשפעה של טיפולים בתאים אנושיים: מאחר שאף מודל בע"ח אינו יכול לשכפל את המחלה האנושית, חשוב לאמת תוצאות ממחקרים בבעלי חיים באמצעות תאים אנושיים ככל שניתן. כיום ניתן להמיר תאי עור שנאספו מאנשים עם תסמונת רט לתאי מוח. תאים אלה יכולים לשמש במעבדות כדי לשכפל את התוצאות שנצפו במודלים של בעלי חיים.
לימוד – עלות המימון 4.5 מיליון דולר ההשקעה שלנו במדע בסיסי הובילה אותנו לשלב החדש והמבטיח של המחקר. התקדמות משמעותית בידע שלנו על הגן המוטנטי מילאה תפקיד מרכזי בהגדרת מרכיבים חשובים של ריפוי גנטי וגישות אחרות. הבנה מלאה של תפקוד הגן והחלבון הקשור אליו חיונית להצלחה של המחקר שלנו.
מפת הדרכים לריפוי היא תוכנית מחקר אסטרטגית מקיפה ומשולבת. אף אחת מן הגישות הללו לא קיימת בבידוד אלא קשורה אחת לשנייה. מפת הדרכים נועדה לנצל במהירות ובקלות תגליות חדשות. אנו בטוחים כי התוכנית תוביל לשיפור מעמיק של יותר מ- 350,000 ילדות ונשים הלוקות בתסמונת רט. במשך זמן רב מדי, הן סבלו ושתקו. אנחנו יודעים שזה אפשרי מבחינה מדעית לשנות את חייהן באופן דרמטי, ואנחנו יודעים איך לגרום לזה לקרות. עכשיו זה הזמן.






